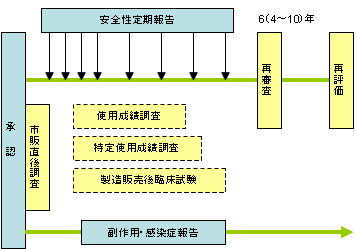
�@���i�̎s�̌�̕i���A�L�����y�ш��S���̊m�ۂ�}�邽�߂�PMS�iPost-marketing Surveillance�j�́A����p�E�����Ǐ��̎��W�E�������x�A�ĐR�����x�y�эĕ]�����x��3�̐��x�ō\������Ă��܂��B
�@�V�̔������悤�ɂȂ�ƁA�����̊��҂̕a�C�̎��ÂɎg����̂ŁA���Ì��ʂ���S���ɂ��āA�����������W�߂邱�Ƃ��K�v�ƂȂ�܂��B���̂��߁A���i�����J���ȁj�ɔF�߂��A�a�C�̎��ÂŎg����悤�ɂȂ�������������A�������s���܂��B���̎����̂��Ƃ��u�����̔���Տ������v�Ƃ����܂��B
�@�����̔���Տ������͖@���iGPSP�j�ɂ���Ē�߂��Ă���A���A���̌��ʂ́A���Ì��ʂ���S���̏��Ƃ��āA���i�����J���ȁj�ɕ���ĂѐR�����s���܂��B
�@�Ȃ��A�����̔��㒲���̂��������̔���Տ������ɂ��Ă͖{��̑��AGCP���K�p����܂��B
GPSP
�@GPSP �i Good Post-Marketing StudyPractice�j�́A�����̔��Ǝғ����s�������̔���̒����y�ю����Ɋւ���Ɩ����K���Ɏ��{����A�܂��A�ĐR���y�эĕ]���̐\�����s���ۂ̎����̐M�������m�ۂ��邽�߂ɁA���炷�鎖�����K�肵����ł��B
�@�]�����A���i�̎s�̌㒲���ɂ�����A���̓K���Ȏ��{�Ǝ����̐M�����̊m�ۂ�ړI�Ƃ��Đ����Ƃ̂���ׂ��̐�����{�K�͂���߂��A������VGPMSP�Ƃ���1991�N6���ɍs���ʒm�Ƃ��Ď�����A1993�N4�����K�p����Ă��܂������A�s�̌㒲���̂���w�̏[��������}�邽��1997
�N3 ���uGPMSP�v�Ƃ��ďȗ߉�����A4��1������{�s����܂����B�i1997�N3��10���A�����ȗߑ�10���j
�@�����@�̎{�s�ɔ����AGPMSP�́A�����̔���̈��S�Ǘ��̊�ł���uGVP�v�Ɛ����̔��㒲���̎��{�̊�ł���uGPSP�v�ɕ������AGPSP�ȗ߂�2005�N4��1������{�s����܂����B�@ |
| �@ |
| Page Index |
|
|
| �@ |
|
|
|
|
| �@ |
|
|
|
 |
|
�@ |
|
�s�̒��㒲���@�@/GVP
�@�V���i�̔̔��J�n����ɂ����āA��Ë@�ւɑ��m���ȏ��A���ӊ��N�����s���A�K���g�p�Ɋւ��闝���𑣂��ƂƂ��ɁA�d�Ăȕ���p�y�ъ�����(�ȉ��u����p���v�Ƃ����B)�̏���v���Ɏ��W���A�K�v�Ȉ��S������{���A����p���̔�Q���ŏ����ɂ��邱�Ƃ���ȖړI�Ƃ���B�V���i���̏��F�̍ہA���F�����Ƃ��Ďw�����ꂽ�ꍇ�ɍs���B�������Ԃ͔̔��J�n��Z�����ԁB
�@ |
�g�p���ђ����@�@/GPSP
�@�f�Âɂ����āA���i���g�p���銳�҂̏������߂邱�ƂȂ��A����p�̔������тɕi���A�L�����y�ш��S���Ɋւ�����̌��o���͊m�F���s�������������B
�@�@ |
����g�p���ђ����@�@/GPSP
�@���F�������͏��F���Ɏw�����ꂽ�ꍇ�Ɏ��{����B�]�O�̓��ʒ������疼�̕ύX�������́B
�@���̂悤�Ȓ���������g�p���ђ����ɊY������B
�@�@�E�����A����ҁA�D�Y�w�A�t�@�\��Q���͊̋@�\��Q��L���銳�ғ����ʂȔw�i��L���銳�҂ɂ�����
�@�@�@����
�@�@�E�����g�p�̊��҂ɂ�����L�����y�ш��S�����ɌW�钲��
�@�@�E���ڂ��ׂ�����p�̔������A�L�����y�ш��S�����ɉe����^����Ǝv����v���̌��o���͊m�F��
�@�@�@���߂̒���
�@�@�E�Ǘ�����Ȃ����̗��R�ɂ����ʊW������ł��Ȃ�����p���W���I�Ɏ��W���A���Y���i�Ƃ�
�@�@�@���ʊW���m�F���邽�߂̒���
�@ |
�����̔���Տ������@�@/GPSP
�@�������͎g�p���ђ����̐��тɊւ��錟�����s�������ʓ���ꂽ���蓙�������A���͐f�Âɂ����Ă͓����Ȃ��i���A�L�����y�ш��S���������W���邽�߂ɏ��F�p�@�E�p�ʁA���\�y�ь��ʂɏ]���s�������������B
�@���i�̗Տ������̎��{�̊�Ɋւ���ȗ߁v(����9�N�����ȗߑ�28��)�����炵�Ď��{����B
�@ |
�ĐR�����x�@�@
�@�ĐR�����x�͐V��×p���i�ɂ��ď��F������ԁi�S�N�`10�N�j�C�g�p�̐��ѓ��Ɋւ��钲���i�s�̌㒲���j���s�킹�C���̌��ʂ�����i�̗L�����C���S�����Ċm�F���鐧�x�ŁC1979�N10���̖@�����ɂ�蓱�����ꂽ�B
�V���i�����F����Ă���ĐR�����鎞���܂ł̒������ԁi�ĐR�����ԁj�͒ʏ�U�N�ł��邪�C���i�ɂ���Ă�4�N�`6�N�C���邢��10�N�̏ꍇ������B
�@ |
�ĕ]���@�@
�@�ߋ��ɏ��F���ꂽ���i�A��Ë@��ɂ��āA�����_�ł̈�w�E��w�̐�������L�����y�ш��S��������������
�@ |
�����̔��㒲�����Ɩ��ɏ]��������̂ɑ��鋳��P�� �@�@/GPSP
�@���̂悤�Ȏ������߂邱�ƁB
�@�@�E���C�v��Ɋւ��鎖��
�@�@�E����P���̑Ώێҋy�ѓ��e�Ɋւ��鎖��
�@�@�E����P���̌��ʂ̕]��
�@
|
|
�����̔��㒲�����Ɩ��ɌW��L�^�̕ۑ� �@�@/GPSP
�@�ۑ��̎菇�ɂ͎��̂悤�Ȏ������߂�B
�@�@�E�ۑ����ꂽ�L�^�̈ڊǂɊւ��鎖��
�@�@�E�ۑ������̐M�����̕ۏɊւ��鎖��
�@�@�E�ۑ������̔p���Ɋւ��鎖��
�@
|
|
|
| �@ |
|
|
|
|
| �@ |
|
|
|
�����S���ҁiMR�j�Ƃ́H�@�i���j�����S���ҋ���Z���^�[
�@ |
MR�̉ʂ����ׂ������@�i���j�����S���ҋ���Z���^�[
�@ |
���f�B�J���ƊE�Ŏ��v���܂�@�����S���҂Ƃ́H�v�@�_�J�[�|
�@ |
��ÊW�҂̋��������@MR�@�����V��
�@ |
MR�@�ߊ�Վ����H�@���w�H�Ɠ���
�@ |
���i������F���C���@�����V��
�@ |
MR�@�u���X�g���E�}�C���[�Y�@�X�N�C�u
�@ |
MR-NET
�@�����S���҂̂��߂̃|�[�^���T�C�g
�@ |
�l�q�@�l�������������@�q�����������������������������̗��B
�@���{����H�Ƌ���P�X�X�P�N�A�����Ƃ̉c�ƐE�̌ď̂Ƃ��Ē�߂��B��×p���i��K���Ɏg�p���邽�߂̏�����ÊW�҂Ɩʐڂ̂����A�E���W����l�̂��Ƃ������B��w�̖�w���o�g�҂����ł͂Ȃ��A�ŋ߂ł͕��n�o�g�҂������ȏ���߂Ă��܂��B�P�X�X�V�N���疯�Ԃ̔F�萧�x���n�܂�A�u��ÂɌg����v�ȂǂƂ��ĔF�m�x�����܂��Ă��܂����B
�@������D�������c�Ƃ͌��݁B�͌��艿�i�̂��ߒl���������Ȃ����u�A�|�C���g�Ȃ��ŕa�@��K����э��݉c�Ƃ͑����v�ƁA�����l�����܂��B�����t���Ă����t�Ɖ���@����ʓI�ȉ��Ăł͏I�Ǝ��Ԃ�z��ł��邽�߁A������e���A���₷���E�Ƃƍl�����Ă��܂��B�t�����X�ł͂W���A�p���ł��V���߂��������Ƃ������v������܂��B |
|
|
�@ |
|
|
|
(1) �����̔��Ƃ̋���
�@���i�A��O�i�A���ϕi�y�ш�Ë@��̐����̔����ƂƂ��čs�Ȃ��ɂ́A�����̎�ނɉ����������̔��Ƃ̋��̎擾���K�v�ł���B�����̔��Ƃ̋��ɂ͎��̂V��ނ�����B
�@�@�@ ��1����i�����̔��Ƌ��F����������i�̐����̔�<BR>
�@�@�A ��2����i�����̔��Ƌ��F����������i�ȊO�̈��i�̐����̔�<BR>
�@�@�B ��O�i�����̔��Ƌ��F��O�i�̐����̔�<BR>
�@�@�C ���ϕi�����̔��Ƌ��F���ϕi�̐����̔�<BR>
�@�@�D ��1���Ë@�퐻���̔��Ƌ��F���x�Ǘ���Ë@��̐����̔�<BR>
�@�@�E ��2���Ë@�퐻���̔��Ƌ��F�Ǘ���Ë@��̐����̔�<BR>
�@�@�F ��3���Ë@�퐻���̔��Ƌ��F��ʈ�Ë@��̐����̔�</FONT>
�@���i�̐����̔��Ƃ́A��t�ł������������̔��ӔC����ݒu���A�����Ǘ��y�ѕi���Ǘ��̊�iGQP ��j���тɐ����̔�����S�Ǘ��̊�iGVP ��j�����炷�邱�Ƃ����v���ł���B���������̔��ӔC�ҁAGQP �S���ł���i���ۏؕ���̐ӔC�҂ł���i���ۏؐӔC�ҋy��GVP �S���ł�����S�Ǘ���������̐ӔC�҂ł�����S�Ǘ��ӔC�҂̂R�҂��u�����̔��O���v�ƌĂ�A�����̔��̐��̒��S��S������ł���B
�@ |
(2) �����Ƃ̋���
�@���i�A��O�i�A���ϕi�y�ш�Ë@����ƂƂ��Đ������邽�߂ɂ́A�����J���ȗ߂Œ�߂�敪�ɉ����������Ƃ̋����擾���Ȃ���Ȃ�Ȃ��B |
|












